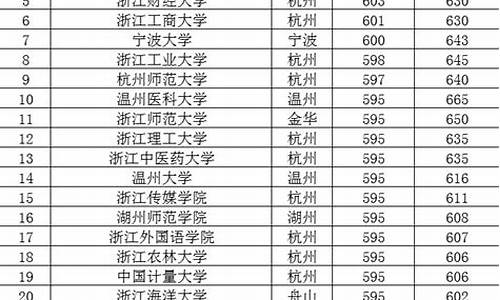
您现在的位置是: 首页 > 教育比较 教育比较
高三化学水溶液中的离子平衡-水溶液中的离子平衡高考题
tamoadmin 2024-10-07 人已围观
简介1.谁给我讲讲水溶液中的离子平衡(盐类水解)的离子浓度怎么比较,遇到这种题的思路是什么,求学霸2.(1)已知铬酸盐(含CrO2-4)或重铬酸盐(含Cr2O2-7)在水溶液中存在下列平衡:2CrO 2?4(**)+2H+?Cr23.物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种.请根据所学谁给我讲讲水溶液中的离子平衡(盐类水解)的离子浓度怎么比较,遇到这种题的
1.谁给我讲讲水溶液中的离子平衡(盐类水解)的离子浓度怎么比较,遇到这种题的思路是什么,求学霸
2.(1)已知铬酸盐(含CrO2-4)或重铬酸盐(含Cr2O2-7)在水溶液中存在下列平衡:2CrO 2?4(**)+2H+?Cr2
3.物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种.请根据所学
谁给我讲讲水溶液中的离子平衡(盐类水解)的离子浓度怎么比较,遇到这种题的思路是什么,求学霸
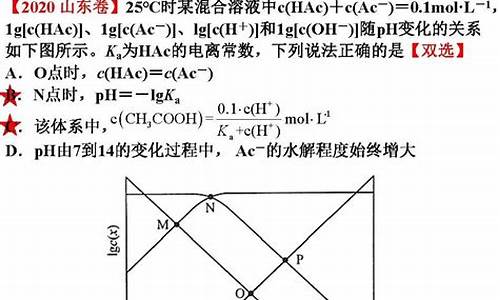
先简单说,比如Na2CO3溶液
1,首先明确电离的很大量,水解是很少量的,
所以先看电离
Na2CO3=2Na++CO32- 完全电离,根据方程式计算
cNa+=2cCO32-
但CO32-弱酸根,有一小部分去参加水解,
实际上cNa+ > 2cCO32-
这两种离子在溶液中占绝大多数
2,判断酸碱性,碳酸钠碱性
于是 cOH->cH+
3,看水解
CO32-+H2O=可逆=HCO3-+OH-......1
HCO3-+H2O-可逆=H2CO3+OH-......2
根据方程式计算第1步 cHCO3-=cOH-,但 还是cHCO3-有很小的去进行2部水解
所以cOH->cHCO3-,
4,水的电离,碳酸钠溶液中的H+完全来自水的电离
H2O=可逆=H++OH-
电离出的cH+=cOH-
这样结合3,4 有cOH->cHCO3-
5,至于比较 HCO3- 和H+ 严谨的应该通过电离常数计算,高中一般碱性溶液H+排在最后
结合1234
Na+ > CO32- > OH- > HCO3- >H+
这些是最基本的判断离子浓度大小的逻辑
(1)已知铬酸盐(含CrO2-4)或重铬酸盐(含Cr2O2-7)在水溶液中存在下列平衡:2CrO 2?4(**)+2H+?Cr2
(1)①分析化合价:CrO
| ? | 2?4 |
| ? | 2?7 |
c(Cr2
| ||
c2(Cr
|
c(Cr2
| ||
c2(Cr
|
②加入足量的NaOH固体,可以与原平衡中的氢离子反应,使化学平衡向逆反应方向移动,所以溶液由橙红色变为**,故答案为:溶液由橙红色变为**;
③加入适量的H2SO4酸化时,氢离子浓度增大,是化学平衡向正反应方向移动,可写出化学方程式为:2Na2CrO4+H2SO4═Na2Cr2O7+Na2SO4+H2O,故答案为:2Na2CrO4+H2SO4═Na2Cr2O7+Na2SO4+H2O;
④Ksp(Ag2CrO4)<Ksp(Ag2Cr2O7),即形成沉淀时,Ag2CrO4所需Ag+浓度最小,即容易形成Ag2CrO4沉淀,故答案为:Ag2CrO4;
(2)氧化还原反应中得失电子数相等,Fe2+氧化为Fe3+,失去0.3mol/L×0.1L=0.03mole-,得电子数=5×10-3mol×2×(6-n)=0.03mol,n=3;根据反应物和生成物,可写出离子方程式为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,故答案为:3;Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种.请根据所学
(1)硫酸铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c (NH4+)>c(SO42-),铵根离子水解程度较小,则溶液中离子浓度大小顺序是c(NH4+)>c(SO42-)>c(H+)>c(OH-),
故答案为:c(NH4+)>c(SO42-)>c(H+)>c(OH-);
(2)碳酸氢钠溶液中存在碳酸氢根离子的水解、电离平衡,还存在水的电离平衡,其方程式分别为,故答案为:HCO3-?H++CO32-、HCO3-+H2O?H2CO3+OH-、H2O?H++OH-,故答案为:HCO3-?H++CO32-、HCO3-+H2O?H2CO3+OH-、H2O?H++OH-;
(3)含有银离子或氯离子的溶液抑制AgCl溶解,氯离子或银离子浓度越大其抑制AgCl溶解程度越大,氯化镁和硝酸银溶液抑制AgCl溶解,但硝酸银是可溶性盐,所以硝酸银溶液中银离子浓度最大,则Ag+浓度由大到小的顺序为②①③,c(Cl-)=
| 1.8×10?10 |
| 0.3 |
故答案为:②①③;6×10-10?mol/L.