您现在的位置是: 首页 > 教育趋势 教育趋势
高中化学选择题蒙题技巧,高考蒙题化学选择题
tamoadmin 2024-05-17 人已围观
简介化学与我们的日常生活息息相关,化学分数总是不高不是因为知识点掌握的不牢固,而是因为考生平时不细心所致的,下面给大家分享一些关于高考化学选择题的答题 技巧大全 ,希望对大家有所帮助。 目录 高考化学选择题的答题技巧 高考化学大题的答题技巧 高考化学经常丢分的地方有哪些? 如何学好高中化学 高考化学选择题的答题技巧 1.排除法
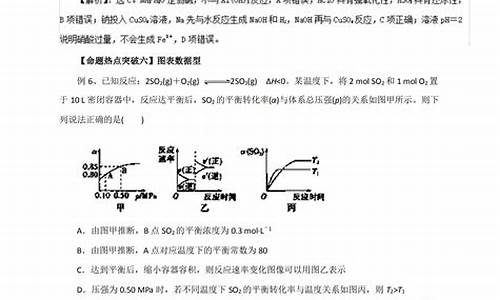
化学与我们的日常生活息息相关,化学分数总是不高不是因为知识点掌握的不牢固,而是因为考生平时不细心所致的,下面给大家分享一些关于高考化学选择题的答题 技巧大全 ,希望对大家有所帮助。
目录
高考化学选择题的答题技巧
高考化学大题的答题技巧
高考化学经常丢分的地方有哪些?
如何学好高中化学
高考化学选择题的答题技巧
1.排除法:排除法是根据已经掌握的化学概念、原理、规律,在正确理解高考化学题意的基础上通过寻找不合理因素(不正确的选项),将其逐一排除,从而获得正确答案。运用排除法的应该注意:
(1)不能漏选,因为有时可供筛选的选项较多,并且文字叙述似是而非,则筛选要逐一处理。
(2)已筛选掉的就不要再拎起来,以免重复。
(3)此法多用于单项选择题。
2.筛选法:将高考化学题目所提供的备选答案进行比较,将与题目要求不相符的分步筛选掉,以求得正确答案。对提供的备选答案具有两重以上的前提条件或正确答案和错误答案彼此相似的题目宜用此法。
3.直选法:对考查基本概念、原理、过程和规律的记忆型单选题,可利用已有知识信息直接选出正确答案。
4.推理法:高考化学解题时从已知条件出发,正确运用概念和原理进行步步逼近的逻辑推理,进而求得正确答案。
5.综合分析法:高考化学对于不易直接判断出正确答案的选择题,常需要进行细致分析,严谨推理判断后才能得出正确答案,解答复杂的选择题多用此法。
>>>
高考化学大题的答题技巧
1.化学方程式的书写要完整无误:没配平、条件错、有机反应少写物质(水等)会造成该空不得分。反应物和产物之间的连接,无机反应用等号、有机反应用箭头,气体符号和沉淀符号要标清,点燃、加热、高温有区别,催化剂不能简写为“催”,这些问题出现会被扣分。
2.专业用语不能错:化学上常用的专业词汇是绝对不能写错别字的,一字之差会使整个空不得分。
3.当答案不唯一或有多种选择时,以最常见的方式作答不易失分。能用具体物质作答的要用具体物质作答,表达更准确。
4.对于语言叙述性题目作答时要注意,从“已知”到“未知”之间的逻辑关系必须叙述准确,且环环相扣,才能保证不丢得分点,才能得满分。回答问题要直接,不要转弯抹角;表达尽可能用唯一、准确的主语;不要多写无用的话,无用的话说错了就会扣分;作答要有明确的要点。
>>>
高考化学经常丢分的地方有哪些?
1.要求写元素名称而错写成元素符号,而要求写元素符号又答成元素名称。
2.要求写物质名称而错写成分子式。
3.要求写有机物的结构简式而错写成分子式或名称。
4.要求写离子方程式而错写成化学方程式。
5.要求画离子结构示意图或电子式而错答为原子结构示意图。
6.化学方程式、离子方程式不配平;条件写错,气体符号、沉淀符号不写。
7.热化学方程式不注明物质的状态等。
8.要求用化学用语而不用的。
9.有机反应中忘写部分生成物的。
10.有机题作答中没注意所给信息或限制条件。
11.读题不清,如选择题中没看清是问“正确”还是“不正确”的。
>>>
如何学好高中化学
1、做好预习,心中有数
每节课前都养成预习的习惯、知道老师上课要讲什么,自己有什么不懂、模糊不清的问题,带着问题去听课,心中有数,课堂听课有的放矢,避免盲目的听,盲目的记,只有认真预习才能提高课堂听课效果
2、认真听课,做好笔记
上课认真听讲,积极思考,学会听课,如老师讲化学反应方程式,听老师分析反应过程,不能只记结果。老师做演示实验,细心观察老师的演示实验操作 方法 ,实验现象。老师讲计算,要听解题思路,掌握解题方法,学会规范解题步骤,一时未听懂的暂时放下接着听,等下课后,再找老师解决遗留问题。化学知识点多而零散,课堂记笔记很重要。书上有的简单记,书上没有的详细记。重点、难点、详细记。兼顾记笔记和听课,不能只听不记笔记,也不能只记笔记而忽略听讲,顾此失彼。
3、及时复习,避免越学越乱
复习并不仅仅是对知识的简单回顾,而是在自己大脑中对学过的知识进行归纳整理,形成知识网络的过程。通过复习加深对知识的理解与掌握,避免出现越学越乱。例如学完同分异构体后,复习时就与同系物、同素异形体、同位素进行对比,找出四个概念的区别,这样才会加深对概念的理解。
4、规范解题,保证作业质量
在写作业时,首先要先看书,整理好笔记,然后再写作业。作业要认真规范,按要求格式去做,不要马虎大意。做完后还要仔细检查有无错误,自觉严格要求,最后 总结 一下所答题目类型,在解题中培养严谨的 学习态度 。
5、适量做题、举一反三、总结规律
做题是理解消化巩固知识的重要途径,选择习题要有针对性,不能陷入题海战术,应以掌握解题方法和解题技巧为目标,注意归纳总结,掌握技巧达到举一反三。例如,无机框图推断题,解题技巧有:特征物理性质切入法、尝试法、计算推理法、逻辑推理法、高频信息切入法。化学计算中常用的技巧法有:守恒法、差量法、估算法、平均值法、十字交叉法、关系式法等。这样坚持总结,形成习惯,学习成绩会不断提高。
6、重视化学实验,培养多种能力
化学实验分为四类:演示实验、边讲边实验、学生实验课、实验习题。演示实验是教师进行的操作,后三类是学生动手进行的。教师的演示实验,能使学生具体地认识物质的外表特征,物质变化条件,现象和规律,帮助学生顺利地形成概念和确信理论的真实性,并能培养学生观察、分析、综合能力,还可以给学生示范正确的实验操作,严谨的科学态度和工作方法。
学生动手实验是学生独立的运用自己获得的知识进行实验操作、观察实验现象、做好实验记录,能更仔细地观察实验现象,对所得物质及其变化的印象更加深刻,从而掌握的知识也更牢固。
7、建立题库,进行学习 反思
把老师发的练习题,考试题都放在自备的习题袋中,以便查找方便,同时对做错的习题用红笔改正过来,对每一个错,要认真分析做错的原因,是知识点没记住,还是审题错误,还是知识不会应用,还是马虎,不能简单写上一个答案了事,对错误原因也用红笔写在错题旁边以示警告。经过一段时间积累,你就会发现自己在学习中存在的问题,针对自己的实际情况,对症治疗,如果知识点不准,则要强化记忆,如是马虎,以后要细心,如果不会应用,应多做些题,对做错的题,隔一段时间拿出来重做,经过这样一改一做会留下很深的印象,以致在今后的学习中少出甚至不出此类错误。
8、学会巧记、事半功倍
化学要记的东西很多很杂,单靠死记硬背是难以记牢的,即使暂时记住了,时间长了也会记忆模糊,因此巧妙地记忆显得非常重要,常用的 记忆方法 有:理解记忆、归纳记忆、口诀记忆,比较记忆等。如盐类的水解,可编成口诀,“无弱不水解,有弱就水解,谁弱谁水解,越弱越水解,都弱都水解,谁强显谁性,同强显中性。”
烷烃系统命名可编成口诀“选主链,称某烷;编号位,定支链;取代基,写在前,标位置,短线连;不同基,简到繁,相同基,合并算。”对于烷烃同分异构体的书写,可编成口诀“主链由长到短;支链由整到散;(支链)位置由心到边;碳(原子)均满足四键;不要重复多算。”学会巧记,就会事半功倍。
化学是一门很有魅力的学科,丰富多彩的实验更使学生感到乐趣无穷,只要我们喜欢化学,再加上科学的 学习方法 和自信,一定能学好化学。
>>>
高考化学选择题的答题技巧大全相关 文章 :
★ 高三化学选择题答题技巧
★ 高考化学答题技巧及注意事项
★ 高考化学答题规范与技巧
★ 高考化学的应试技巧有哪些
★ 2020高考化学答题规范与技巧
★ 2020年高考理综化学答题技巧
★ 高三化学的考试技巧
★ 2020高考化学实验题高分技巧汇总
★ 做选择题的技巧规律总结
★ 做高考化学实验题中的步骤
var _hmt = _hmt || []; (function() { var hm = document.createElement("script"); hm.src = ""; var s = document.getElementsByTagName("script")[0]; s.parentNode.insertBefore(hm, s); })();选择题是化学考试必考题型,一般考得知识点都不会很难,下面就是我给大家带来的 2020 高考化学选择题知识 ,希望大家喜欢!
高考化学选择题知识
1.Li是周期序数等于族序数2倍的元素。
2.S是最高正价等于最低负价绝对值3倍的元素。
3.Be、Mg是最外层电子数与最内层电子数相等的元素;
4.Li、Na是最外层电子数是最内电子数的1/2的元素;
5.最外层电子数是最内层电子数的2倍的是C、Si;3倍的是O、S;4倍的是Ne、Ar。
6.Be、Ar是次外层电子数等于最外层电子数的元素;
7.Na是次外层电子数等于最外层电子数8倍的元素。
8.H、He、Al是原子最外层电子数与核外电子层数相等。
9.He、Ne各电子层上的电子数都满足2n2的元素。
10.H、He、Al是族序数与周期数相同的元素。
11.Mg是原子的最外层上的电子数等于电子总数的1/6的元素;
12.最外层上的电子数等于电子总数的1/3的是Li、P;1/2的有Be;相等的是H、He。
13.C、S是族序数是周期数2倍的元素。
14.O是族序数是周期数3倍的元素。
15.C、Si是最高正价与最低负价代数和为零的短周期元素。
16.O、F是最高正价不等于族序数的元素。
17.子核内无中子的原子 氢( H)
18.形成化合物种类最多的元素 碳
19.地壳中含量前三位的元素 O、Si、Al
20.大气中含量最多的元素 N
21.最外层电子数为次外层2倍的元素(或次外层电子数为最外层1/2的元素)C
22.最外层电子数为次外层3倍的元素(或次外层电子数为最外层1/3的元素) O
23.最外层电子数为次外层4倍的元素(或次外层电子数为最外层1/4的元素)Ne
24.最外层电子数为次外层电子数1/2的元素Li、Si
25.最外层电子数为次外层电子数1/4的元素 Mg
高中化学知识重点
一、含量与物理性质
1.O是地壳中质量分数最大的元素,Si次之,Al是地壳中质量分数最大的金属元素。
2.H是最轻的非金属元素;Li是最轻的金属元素。
3.Na是焰色反应为**的元素;K是焰色反应为紫 色(透过蓝色的钴玻璃观察)的元素。
4.Si是人工制得纯度最高的元素;C是天然物质中硬度最大的元素。
5.N是气态氢化物最易溶于水的元素;O是氢化物沸点最高的非金属元素。
6.常温下,F、Cl是单质具有有色气体的元素。
7.C是形成化合物种类最多的、最高价氧化物的含量增加会导致“温室效应”的元素。
8.Cl是单质最易液化的气体、最高价氧化物的 水化物酸性最强的元素。
二、化学性质与用途
1.F是单质与水反应最剧烈的非金属元素。
2.N是气态氢化物与其最高价氧化物对应水化物能起化合反应的元素。
3.S是气态氢化物与其低价氧化物能反应生成该元素的元素。
4.P是在空气中能自燃的元素。
5.F是气态氢化物的水溶液可以 雕刻 玻璃的元素。
6.O是有两种同素异形体对人类生存最为重要的元素。
7.Mg是既能在CO2中燃烧,又能在N2中燃烧的金属单质。
8.Li、Na、F的单质在常温下与水反应放出气体的短周期元素。
三、电子微粒组
1.原子Ne
2.分子CH4、NH3、H2O、HF
3.阳离子Na+、Mg2+、Al3+、H3O+
4.阴离子N3-、O2-、F-、OH-
四、18粒子微电组
1.原子Ar
2.分子SiH4、PH3、H2S、HCl、F2、H2O
3.阳离子K+、Ca2+、PH4+
4.阴离子P3-、S2-、Cl-
5.特殊情况:F2、H2O2、C2H6、CH3OH、CH3F 、N2H4
高中化学基础知识
1、影像化学反应速率的因素
(1)内因(决定因素)
化学反应是由参加反应的物质的性质决定的。
(2)外因(影响因素)
①浓度:当其他条件不变时,增大反应物的浓度,反应速率加快
注意:增加固体物质或纯液体的量,因其浓度是个定值,故不影响反应速率(不考虑表面积的影响)
②压强:对于有气体参加的反应,当其他条件不变时,增大压强,气体的体积减小,浓度增大,反应速率加快。
注意:由于压强对固体、液体的体积几乎无影响,因此,对无气体参加的反应,压强对反应速率的影响可以忽略不计。
③温度:当其他条件不变时,升高温度,反应速率加快。
一般来说,温度每升高10℃,反应速率增大到原来的2~4倍。
④催化剂:催化剂有正负之分。使用正催化剂,反应速率显著增大;使用负催化剂,反应速率显著减慢、不特别指明时,指的是正催化剂。
2、外界条件同时对V正、V逆的影响
(1)增大反应物浓度时,V正急剧增加,V逆逐渐增大;减小反应物的浓度,V正急剧减小,V逆逐渐减小
(2)加压对有气体参加或生成的可逆反应,V正、V逆均增大,气体分子数大的一侧增大的倍数大于气体分子数小的一侧增大的倍数;降压V正、V逆均减小,气体分子数大的一侧减小的倍数大于气体分子数小的一侧减小的倍数。
(3)升温,V正、V逆一般均加快,吸热反应增大的倍数大于放热反应增加的倍数;降温时,V正、V逆一般均减小,吸热反应减小的倍数大于放热反应减小的倍数。
3、可逆反应达到平衡状态的标志
(1)V正=V逆,如对反应mA(g)+nB(g)======pC(g)
①生成A的速率与消耗A的速率相等。
②生成A的速率与消耗B的速率之比为m:n
(2)各组成成分的量量保持不变
这些量包括:各组成成分的物质的量、体积、浓度、体积分数、物质的量分数、反应的转换率等。
(3)混合体系的某些总量保持不变
对于反应前后气体的体积发生变化的可逆反应,混合气体的总压强、总体积、总物质的量及体系平均相对分子质量、密度等不变
1、影像化学反应速率的因素
(1)内因(决定因素)
化学反应是由参加反应的物质的性质决定的。
(2)外因(影响因素)
①浓度:当其他条件不变时,增大反应物的浓度,反应速率加快。
注意:增加固体物质或纯液体的量,因其浓度是个定值,故不影响反应速率(不考虑表面积的影响)
②压强:对于有气体参加的反应,当其他条件不变时,增大压强,气体的体积减小,浓度增大,反应速率加快。
注意:由于压强对固体、液体的体积几乎无影响,因此,对无气体参加的反应,压强对反应速率的影响可以忽略不计。
③温度:当其他条件不变时,升高温度,反应速率加快。
一般来说,温度每升高10℃,反应速率增大到原来的2~4倍。
④催化剂:催化剂有正负之分。使用正催化剂,反应速率显著增大;使用负催化剂,反应速率显著减慢、不特别指明时,指的是正催化剂。
2、外界条件同时对V正、V逆的影响
(1)增大反应物浓度时,V正急剧增加,V逆逐渐增大;减小反应物的浓度,V正急剧减小,V逆逐渐减小
(2)加压对有气体参加或生成的可逆反应,V正、V逆均增大,气体分子数大的一侧增大的倍数大于气体分子数小的一侧增大的倍数;降压V正、V逆均减小,气体分子数大的一侧减小的倍数大于气体分子数小的一侧减小的倍数。
(3)升温,V正、V逆一般均加快,吸热反应增大的倍数大于放热反应增加的倍数;降温时,V正、V逆一般均减小,吸热反应减小的倍数大于放热反应减小的倍数。
3、可逆反应达到平衡状态的标志
(1)V正=V逆,如对反应mA(g)+nB(g)======pC(g)
①生成A的速率与消耗A的速率相等。
②生成A的速率与消耗B的速率之比为m:n
(2)各组成成分的量量保持不变
这些量包括:各组成成分的物质的量、体积、浓度、体积分数、物质的量分数、反应的转换率等。
(3)混合体系的某些总量保持不变
对于反应前后气体的体积发生变化的可逆反应,混合气体的总压强、总体积、总物质的量及体系平均相对分子质量、密度等不变。
2020高考化学选择题常考知识点汇总相关 文章 :
★ 2020高考化学重要知识点归纳整理
★ 2020高考化学重要知识点归纳大全
★ 2020年高考化学最全重点知识点归纳
★ 2020高考化学重要知识点详细总结
★ 2020高考化学重要知识点大全
★ 2020高考化学必考知识点汇总
★ 2020高考化学高频考点知识汇总
★ 2020高考化学必考的知识总结
★ 2020高考化学知识要点总结
★ 2020高考化学知识点总结归纳









